INTRODUCCIÓN
Una de las principales preocupaciones dentro del campo de la química era descubrir cómo se agrupaban los átomos para formar las moléculas y lo interesante de ver cómo estas reaccionan para formar las diferentes moléculas. Se explica que los átomos se combinan en relaciones fijas bien definidas para constituir las moléculas, de donde una sustancia dada se puede describir a través de su fórmula molecular. Estas fórmulas reflejan las valencias, o potencia de combinación, de los átomos. El átomo está rodeado por electrones en torno al núcleo y que estos pueden describirse siguiendo un modelo orbital.

Algunos
puntos importantes a considerar en relación con los compuestos que contienen
enlaces iónicos.
Primero:
con la transferencia de electrones pueden resultar grandes cambios en las
propiedades. Un ejemplo seria, los átomos de sodio es un sólido metálico activo
y suave que se puede cortar con un cuchillo.
Segundo:
la carga del ion está relacionada con la cantidad de protones y de electrones
que se encuentran en él. En el átomo de sodio hay 11 protones en el núcleo y 11
electrones a su alrededor; por tanto, el átomo es neutro. En el ion sodio hay
todavía 11 protones en el núcleo, pero sólo tiene 10 electrones porque perdió
uno para el átomo de cloro. El resultado es la carga neta de un protón, es
decir, una carga positiva en exceso, que da una carga iónica o número de
oxidación al ion +1. En el átomo de cloro hay 17 protones en el núcleo y 17
electrones alrededor de éste; el átomo es neutro. Después de recibir un
electrón del sodio, se convierte en un ion con 18 electrones alrededor del
núcleo y 17 protones en el núcleo, lo que da como resultado la carga neta de un
electrón, es decir, una carga negativa en exceso que da una carga iónica o
número de oxidación en el ion cloro.
Tercero:
los radios de los iones son diferentes a los radios de los átomos. El radio del
átomo de sodio es de 186 pm y el radio del ion sodio es de 95 pm, esta
disminución del radio es el resultado de la perdida de electrones en un nivel
de energía, ya que el tercer nivel principal de energía del átomo de sodio se
quedó vacío después de haber transferido un electrón al átomo de cloro. Una
disminución adicional al tamaño debida a la fuerte atracción nuclear ejerce los
11 protones con carga positiva sobre los 10 electrones restantes, una
disminución de la repulsión entre los electrones ahora que sólo quedan 10
alrededor del núcleo.
¿Qué es
lo que mantiene unidos aniones y cationes en una red cristalina?
La respuesta es la atracción eléctrica ejercida entre las cargas positivas y
negativas. Esta atracción forma un enlace químico entre los iones como
resultado de la que se ejerce entre cargas opuestas. Estos enlaces químicos son
de género electrovalente o
iónico. Para que los átomos de sodio neutro, Na", formen iones de sodio
positivos, Na+, cada uno debe perder un electrón. El cloruro de sodio (sal
común de mesa), es un sólido iónico muy conocido. La reacción entre el metal sodio
y el gas cloro para formar
cloruro de sodio se escribe de esta manera.
2Na(s) + Cl2(g)
2NaCl(s)
Un
cristal de cloruro de sodio no contiene moléculas de NaCl.
La distribución del
par de electrones entre los dos átomos ligados no es igual. El átomo que atrae
con mayor fuerza al
par de electrones adquiere más de esa carga y desarrolla lo que se llama una
carga negativa parcial, una parte de una carga electrónica. El
otro átomo desarrolla una carga positiva parcial de la misma magnitud.
Enlaces
covalentes: los enlaces covalentes se forman cuando los átomos comparten sus
electrones. La unidad más pequeña del compuesto covalente formada por este
enlace es una molécula.
Los
compuestos que tienen enlaces covalentes tienen propiedades diferentes a las de
los compuestos que tienen enlaces iónicos. los compuestos covalentes tienen
puntos de fusión relativamente
inferiores (menos de 300gradados C) y no conducen la corriente eléctrica como
lo hacen los compuestos iónicos en las soluciones liquidas
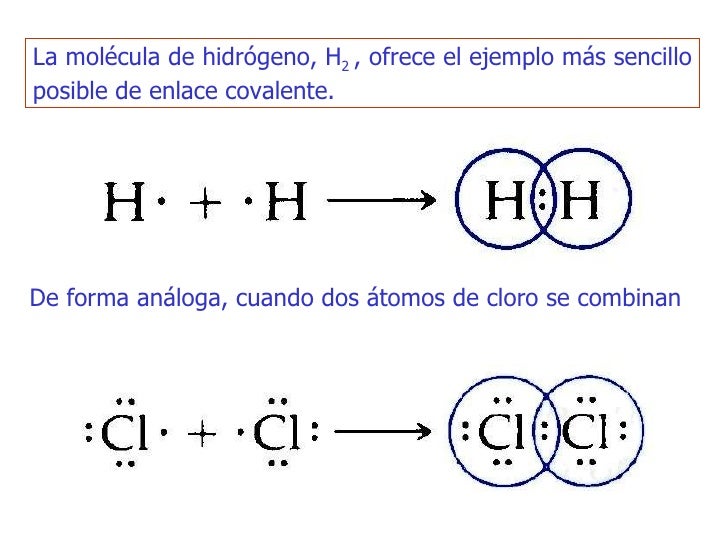
o acuosas. La molécula de hidrogeno es
un ejemplo sencillo se un compuesto covalente.
En la
molécula de hidrogeno como en todos los compuestos con enlaces covalentes hay
cuatro aspectos muy importantes.
El
primero, al igual que los compuestos iónicos las propiedades de los átomos
individuales sin combinar son muy diferentes a las propiedades de las
moléculas.
El
momento dipolar de una molécula es la medida experimental de la distribución
desigual neta de la carga en dicha molécula.
En el
caso de una molécula poliatómica, la sola polaridad del enlace no puede
explicar cualitativamente la polaridad neta de la molécula. También, interviene
la orientación espacial de los enlaces dentro de las moléculas. El CCl4 tiene
cuatro enlaces covalentes polares dirigidos hacia los vértices del tetraedro.
Si los
enlaces químicos fueran totalmente iónicos o totalmente covalentes las
moléculas no formaría dipolos y entonces muchos compuestos no existirían en los
estados líquido y solido excepto bajo condiciones extremas, como las que se
requieren para los gases nobles.
Entonces
pues se llega a la conclusión que los mismo enlaces covalentes poden ser
polares. Los enlaces intermedios se llaman también enlaces polares covalentes.
Los pares
de electrones compartidos entre dos átomos diferentes no están necesariamente
compartidos por igual.
Los
enlaces que existen en la mayor parte de las sustancias covalentes se
encuentran entre estos dos extremos.
El concepto de
polaridad de enlace es útil para describir en qué grado se comparten los
electrones entre dos átomos.
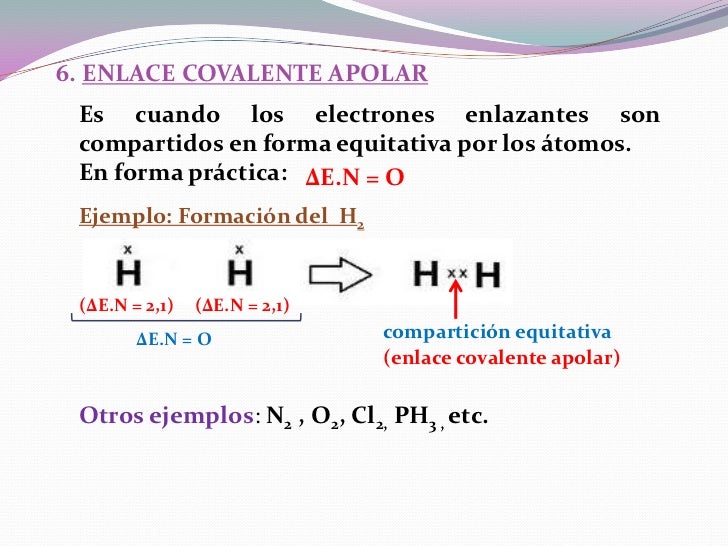
Un enlace
no polar es aquel en el que los que electrones se comparten por igual entre los
dos átomos. En un enlace covalente polar uno de los átomos ejerce mayor
atracción por los electrones que el otro.

 Electronegatividad:
utilizamos una magnitud denominada electronegatividad para estimar si un enlace
dado puede ser o no polar, o iónico. La electronegatividad se define como la
capacidad de un átomo en una molécula para atraer electrones hacia el mismo.
Electronegatividad:
utilizamos una magnitud denominada electronegatividad para estimar si un enlace
dado puede ser o no polar, o iónico. La electronegatividad se define como la
capacidad de un átomo en una molécula para atraer electrones hacia el mismo.
La
energía de ionización mide que tan fuerte atrae un átomo a sus electrones. La
afinidad electrónica es una medida de la fuerza que tiene un átomo para atraer
electrones adicionales.
Se puede
concluir que estos enlaces tienen propiedades muy diferentes, y esta diversidad
individualiza nuestro ambiente aunque
estas moléculas sean infinitesimales y gracias a eso forman estructuras muy
exóticas, y los enlaces definen estas formas, desde la extraña molécula
del agua y
sus cristales únicos hasta el cloruro de sodio, conocida mejor como la sal de
mesa y sus cúbicos y simples cristales.
Por
ejemplo sabemos que los átomos del sodio y del cloruro son muy diferentes al
cloruro de sodio, esto viene porque el sodio es un sólido metálico activo que
se puede cortar con un cuchillo en cambio el
cloro es un gas venenoso y verdoso que tiene un olor fuerte e irritante el
cloruro de sodio es un sólido cristalino blanco que es comestible.
(SUMMERLIN, 1981) (TLEREIIE)
(WENDELL, 1968)
(Wiliam & walliams, 2005)
(ZUMDAHL, 1995)
Autor:
Javier
Eduardo Martínez G.
Efrén
Ronquillo Ramos
Juan
Armando García M.
Luis
David Villareal L.
Juan
Alberto Quirino V.
Maestro:
Pedro
Zambrano
INSTITUTO TECNOLÓGICO DE
CHIHUAHUA
Comentarios
Publicar un comentario